1.首要原则:细胞不重要情况下立即丢弃,培养箱灭菌,所用培养基也都要丢弃,器械等重新灭菌或拆用新的。2.细菌污染一般都救不回来了,发现的时候培养基一般都很浑浊且细胞都死了3.污染且细胞很重要时:遇到念球菌污染,且细胞为基因改造细胞,非常重要。如231贴壁乳腺细胞,发现细胞周围出现很小的串珠透亮圆点,非常像念球菌污染,此时细胞状态尚可,且污染少。处理如下:用预热或室温PBS清洗3次,可适当振摇,将污染冲洗下来。随后加入10-20%双抗到培养瓶,置于37度培养箱1h,之后再用PBS清洗三遍,直至视野下无可见污染。此时细胞也被冲下大部分,因此此方法只适用在细胞贴壁强,状态好,密度高时使用。之后每天再更换培养基,每次用PBS冲洗2遍。过几天细胞状态尚可时,消化离心时用500r,3min,去掉上清,重复3次。这个方法是根据文献可利用念球菌和细胞体积重量差异实现分离。基本上这一步做完以后,污染就基本了,接下来就注意多观察,勤换液就行。动物疾病模型在科研中发挥了巨大的作用,但也存在一些挑战。上海组织科研技术服务购买
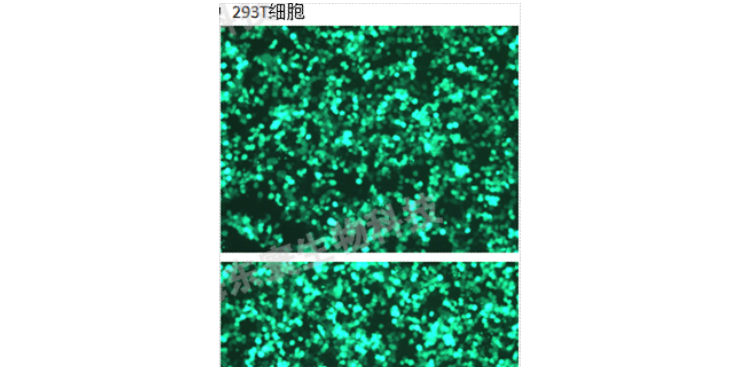
采用opti-MEM和Lipo3000分别转染含有目的基因的pMSCV-eGFP、VSV、GAG质粒及对照载体,每皿加入脂质体-质粒转染混悬液按购买脂质体相关说明书操作定量。继续培养24h。2)24小时后,将培养基更换为新鲜的DMEM完全培养基,放进细胞培养箱继续培养48~72h。3)48~72h后收集上层培养液,并过μm滤膜,采用ELISA法对所获得的慢载体进行滴度测定。如不及时使用可以冻存于-80℃。3、慢转染1)转染前1天将细胞接种6孔培养板,时细胞的融合率约为50%,前需换液,加入1mLDMEM完全培养基。2)冰浴融化后加入相应体积的液及聚凝胺(Polybrene),混匀后放入37℃孵箱中继续培养3)4h后补充1mL培养基,14h后换液(24h内换液即可)。4)72h后用倒置显微镜观察荧光,监测效率,出现较多荧光时将等量的转染细胞和未转染细胞分别加入等浓度Puromycin(Puromycin或其他筛选浓度需要事先摸索)。5)待未转染细胞全部死亡并且可观察到满意荧光量时,降低Puromycin浓度培养。也可以挑去单克隆细胞株进行进一步培养,以得到满意的稳定表达目的基因的细胞株。6)使用qRT-PCR和Westernblot的方法检测目的基因的表达量和蛋白水平是否显著提高。7)由此可得三组细胞株:a.正常细胞株;b.空载载体的细胞株。上海外包科研技术服务购买细胞培养板的选购要注意哪些?

在人类疾病研究中数据表明,常用实验动物模型按产生原因分为以下5类:自发性动物模型、诱发型动物模型、遗传工程动物模型、生物医学动物模型和阴性动物模型。下面上海研录带大家一起看看吧:1、自发性动物模型:是指动物未经任何有意识的人工处理,在自然条件下或基因突变条件下所产生的疾病模型。主要包括突变型的遗传病模型和近郊系的疾病模型。2、诱发型动物模型:亦称实验性动物模型。是使用物理、化学或生物致病因素诱导动物产生某些类似人类疾病表现而制备的动物模型。此模型具有制备方法简单,实验条件容易控制,重复性好等特点,广泛应用于药物筛选、毒理、传染病、病理机制的研究。3、遗传工程动物模型:是利用遗传工程技术对动物基因组进行修饰,用于研究基因功能或疾病机制的动物模型。也称基因修饰动物模型,是指利用胚胎工程和基因工程等生物技术有目的的干预动物的遗传组成,导致动物出现新的性状,并使其能够有效地遗传下去,形成新的可供生命科学研究的和其他目的所用的动物模型。4、生物医学动物模型:也是指利用健康生物的特定生物学特征,研究人类疾病相似表现得模型。这类动物模型与人类疾病存在一定的差异,研究者应加以比较,从中获得有关材料。
转录组测序结果及TCGA数据库分析)图5RNA-Seq和m6A-seq联合鉴定SOCS2是介导的m6A修饰的下游靶基因PLoSOne2015,在许多不同种类的RNA中,都已观察到N6-腺苷(m6A)的甲基化,但其在microRNAs中还没有被研究。研究者在FTO1C1,FTO2D4和FTO3C3细胞系中,通过敲除m6A甲基转移酶FTO筛选到表达差异的microRNA,说明miRNA受m6A甲基化的调控。进一步通过MeRIP-Seq发现相当一部分的microRNA具有m6A修饰。通过motif分析,他们发现了区分甲基化和非甲基化microRNA的一致序列。该文章所述的表观遗传修饰在基因表达的转录调控的复杂性上增加了一个新的层次。图FTO敲除对甲基化的miRNAs的稳定状态的影响。参考文献Y,DominissiniD,RechaviG,HeC:Geneexpressionregulationmediatedthroughreversiblem(6)(5):(1):(12):(6):(1):(1):(uridine)(41):(6)(7540):(1):(7481):(4):(6)A-LAIC-seqrevealsthecensusandcomplexityofthem(6)(8):UTRm(6)(4):(7544):(6)(6):(5):(7667):(2):"">panstyle="color:#f5c81c;">xiainducesthebreastcancerstemcellphenotypebyHIF-dependentandALKBH5-mediatedm(6)(14):"">panstyle="color:#f5c81c;">(40):(6)(3):(1):(1):(4):(11):。干货分享 | TUNEL法检测细胞凋亡原理和经验.
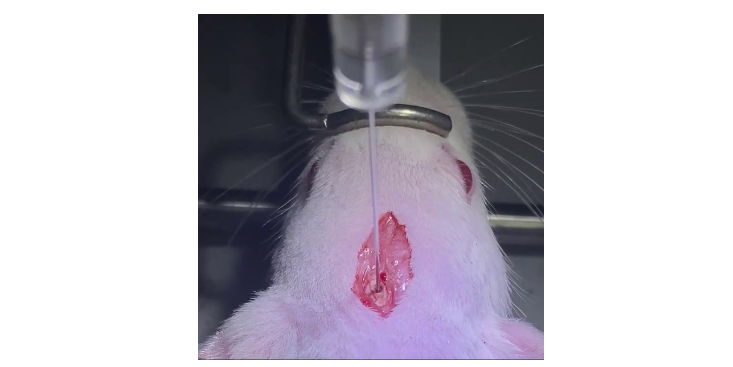
制作该模型的方法为大鼠腹腔麻醉消毒后选取腹部正中切口打开腹腔长约2cm,寻找盲肠,小心分离其远端与大肠的系膜,在盲肠远端1/2处用无菌4号丝线紧紧结扎,并用无菌7号针头在已结扎盲肠远端处贯通穿刺,然后把盲肠推回腹腔,关闭腹腔。影响因素多数研究一致认为盲肠结扎位置是CLP模型中死亡率和疾病严重程度的主要决定因素。结论为:①结扎25%或以下的盲肠死亡率几乎为零,为轻度脓毒症;②结扎50%~60%的盲肠导致术后死亡率为60%,为中度脓毒症;③结扎75%或以上的盲肠导致小鼠在术后2~3d内全部死亡,为重度脓毒症。而在不同程度脓毒症中,死亡主要集中在初的48h内。有研究通过改变盲肠结扎位置和穿刺针直径来调节脓毒症的严重程度,其中提到与结扎长度小于1cm的小鼠相比,结扎长度超过1cm的小鼠死亡率增加至100%;增加穿刺针的直径也使得存活率从100%(22G针)降低至55%(19G针)。结论为:在上述两个因素中,盲肠结扎位置比针头大小影响更为。CLP诱导的脓毒症术后6h即可出现菌血症,术后约12h出现脓毒症相关临床症状,包括发热、寒战、毛发竖立、全身无力和活动减少等,术后18h开始死亡。总之,在制作CLP模型时。细胞转染又分为瞬时转染和稳定转染,瞬时转染是指外源基因进入受体细胞后.上海小鼠科研技术服务分离
在疫苗测试中,动物模型则可以用来评估疫苗的有效性和安全性。上海组织科研技术服务购买
RNA甲基化修饰(m6A)研究RNA甲基化修饰约占所有RNA修饰的60%以上,而N6-甲基腺嘌呤(N6-methyladenosine,m6A)是高等生物mRNA和lncRNAs上为普遍的修饰。目前发现microRNA,circRNA,rRNA,tRNA和snoRNA上都有发生m6A修饰。m6A修饰主要发生在RRACH序列中的腺嘌呤上,其功能由“编码器(Writer)”、“消码器(Eraser)”和“读码器(Reader)”决定[1]。“编码器(Writer)”即甲基转移酶,目前已知这个复合物的成分有METTL3,METTL14,WTAP和KIAA1429;而ALKBH5和FTO作为去甲基酶(消码器)可逆转甲基化;m6A由m6A结合蛋白识别,目前发现m6A结合蛋白(读码器)有YTH结构域蛋白(包括YTHDF1,YTHDF2,YTHDF3,YTHDC1和YTHDC2)和核不均一蛋白HNRNP家族(HNRNPA2B1和HNRNPC)。m6A酶系统METTL3是早先被鉴定为结合SAM的组件,其缺失引起小鼠胚胎干细胞、Hela细胞和HepG2细胞中m6Apeaks的减少。METTL3及其同源蛋白METTL14定位在富含剪切因子的细胞核内亚细胞器-核小斑(Nuclearspeckle)上,显示m6A修饰可能和RNA的剪切加工相关。WTAP与METTL3–METTL14二聚体相互作用,并共定位于核小斑,影响甲基化效率,参与mRNA剪。而KIAA1429作为候选的甲基转移酶复合体的新亚基。上海组织科研技术服务购买
文章来源地址: http://yyby.jzjcjgsb.chanpin818.com/swzp/ktky/deta_27675941.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。



 [VIP第1年] 指数:3
[VIP第1年] 指数:3